2017年高考理综化学压轴试题(含答案)
化学
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32
1.下列反应中能量变化与其它不同的是
| A.铝热反应 | B.燃料燃烧 | C.酸碱中和反应 | D.Ba(OH)2•8H2O与NH4Cl固体混合 |
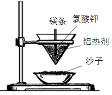 |  |  |  |
2.晋葛洪《抱朴子内篇·黄白》记载“曾青涂铁,铁赤色如铜”(“曾青”是指硫酸铜)。下列说法不正确的是
A.记载中的反应属于置换反应 B.记载中蕴含了湿法炼铜的原理
C.由记载得出铁单质是赤色(红色) D.每生成1mol铜转移2mol电子
3.相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若分子数相等,则体积相等 B.若原子数相等,则中子数相等
C.若质量相等,则质子数相等 D.若体积相等,则质量数相等
4.关于阿司匹林,下列说法正确的是
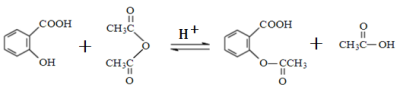
水杨酸 乙酸酐 阿司匹林
A.不能用FeCl3 溶液鉴别水杨酸和阿司匹林
B.服用阿司匹林出现水杨酸反应时,可静脉注射NaHCO3溶液
C.1 mol阿司匹林最多可消耗2 mol NaOH
D.该反应不属于取代反应
5.高炉炼铁的主要反应为:CO(g) + ![]() Fe2O3(s) CO2(g) +
Fe2O3(s) CO2(g) + ![]() Fe(s) 已知该反应在不同温度下的平衡常数如下:
Fe(s) 已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
下列说法正确的是
A.增加Fe2O3固体可以提高CO的转化率
B.该反应的ΔH<0
C.减小容器体积既能提高反应速率又能提高平衡转化率
D.容器内气体密度恒定时,不能标志反应达到平衡状态
6.下列解释事实的反应方程式正确的是
A.亚硫酸钠水溶液显碱性:SO32-+2H2O H2SO3+2OH-
![]() B.SO2的水溶液显酸性:SO2+H2O H2SO32H++ SO32-
B.SO2的水溶液显酸性:SO2+H2O H2SO32H++ SO32-
C.燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2 +O2 2CaSO4 +2CO2
D.浓NaOH溶液处理少量二氧化硫:SO2+ OH-=== HSO3-
7.下列实验装置不能达到实验目的的是
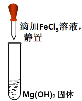 | 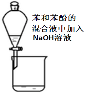 | 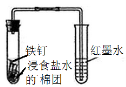 |  |
| 验证沉淀转化
A | 除去苯中的苯酚
B | 观察铁的吸氧腐蚀
C | 检验乙炔的还原性
D |
8.(17分)“张-烯炔环异构化反应”被《Name Reactions》收录。该反应可高效合成五元环状化合物:

(R1代表氢原子或烃基,X代表氧原子或氮原子)
某五元环状化合物I(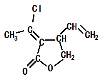 )的合成路线如下:
)的合成路线如下:
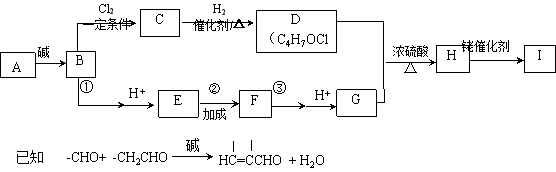
(1)烃的含氧衍生物A的相对分子质量为44,核磁共振氢谱显示分子中含有两种氢,则A的名称为_______。
(2)A→B的化学反应方程式为_____________________。
(3)写出D顺式结构的结构简式_______________,B→C的反应类型为________。
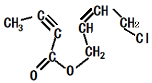
(4)写出H的结构简式 。
(5)①的化学试剂是 。
(6)写出③的化学方程式 。
(7)下列说法正确的是__________。
a.H→I的过程中涉及到单键、双键和三键的断裂以及单键和双键的形成
b.C、D、E、F均能使溴的四氯化碳溶液褪色
c.与F含有相同官能团的同分异构体有8种(不含F本身)
9.(13分)中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为![]()
![]() ,则其在周期表中的位置是_____________。
,则其在周期表中的位置是_____________。
(2)N元素非金属性比As强,下列说法正确的是_______。
①NH3的热稳定性比AsH3差
②HNO3的酸性比H3AsO4强
③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的热化学方程式_。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
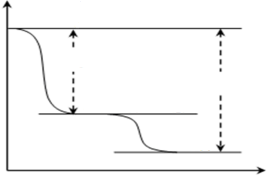
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应_______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括_______。
③写出过程Ⅲ的离子方程式______,
过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因___。
10.(13分)氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以 [Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
I.电解处理法
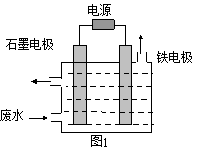 用图1所示装置处理含CN-废水时,控制溶液pH为9~10 并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。
用图1所示装置处理含CN-废水时,控制溶液pH为9~10 并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。
(1)铁电极为___________(填“阴极”或“阳极”),
阳极产生ClO-的电极反应为______________________。
II.UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH—===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;②[Fe(CN)6]3-转化为CN-容易被H2O2除去;③HCN是有毒的弱酸,易挥发。
(2)废水中的CN一经以下反应实现转化:CN一+H2O2+H2O===A+NH3↑,则A是 (用符号表示)。
(3)K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应___________________。
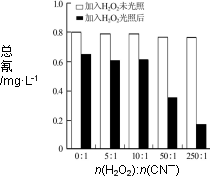
(4)含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为______(a.7-10;b.10-11;c.11-13),解释选择该pH范围的原因_______。
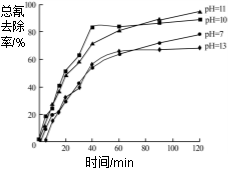
![]()

(5)图3表示某pH时,加入不同量H2O2,处理30min后测定的样品含氰浓度。由图可知:n(H2O2):n(CN-)=250:1时,剩余总氰为0.16 mg·L-1,除氰率达80%,计算0-30 min时间段反应速率v(CN-)= ____________mg·L-1min-1(结果保留两位有效数字)。
11.某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。(15分)
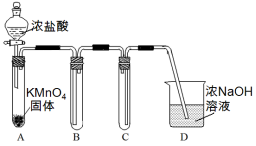 Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适
量Cl2,装置B、C的作用分别是
___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有___(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是__(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | 6mL | 3mL | 0mL |
| 硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色,
生成黄绿色气体 |
①该系列实验的目的__。
②烧杯3取用硫酸的体积应为______________ mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2 _____________。
化学参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | D | C | A | B | B | C | D |
阅卷说明:
1.化学方程式评分标准:
(1)化学(离子)方程式中,离子方程式写成化学方程式2分的给1分,1分的写对不给分。
(2)反应物、生成物化学式均正确得1分,有一种物质的化学式错即不得分。
(3)不写条件或未配平,按要求看是否扣分。
(4)不写“↑”或“↓”不扣分。
2.简答题中加点部分为给分点。
3.合理答案酌情给分。
8.(17分)(除特别注明,均每空2分)
![]()
![]()
![]()
![]() (1)乙醛
(1)乙醛
(2)
(3)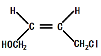 , 取代反应
, 取代反应
(4)
(5)银氨溶液(或新制氢氧化铜悬浊液)
(6)![]() (3分)(Cl换成Br给分)
(3分)(Cl换成Br给分)
(7)a c
9.(13分) (除特别注明,均每空2分)
(1)第四周期, VA族
(2)②③
(3)As2O5(s) ===As2O3(s) + O2(g)△H= + 295.4 kJ·mol-1
(4)①不是
②浓缩结晶,过滤,洗涤,烘干(过滤,洗涤是给分点,)
③ 2AsO4 3-+ 2SO2 + 2H+ === As2O3 + 2SO42- + H2O
酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率。
10.(13分)(除特别注明,均每空2分)
(1)阴极
2OH-+Cl--2e-=== ClO-+H2O
(2)HCO3-
(3)[Fe(CN)6]3-+3 H2O Fe(OH)3 + 3HCN + 3CN-
(或K3[Fe(CN)6] +3 H2O Fe(OH)3 + 3HCN + 3KCN)其它合理答案均可
(4)b 碱性适中,有利于[Fe(CN)6]3-转变为CN-而被氧化,碱性太强溶液中4[Fe(CN)6]3-+4OH—=== 4[Fe(CN)6]4-+O2↑+2H2O生成[Fe(CN)6]4-后难以除去,碱性太弱[Fe(CN)6]3-难以水解释放出CN-(且水解产生少量HCN有毒)
(5) 0.021
11.(15分)(除特别注明,均每空2分)
(1) 收集氯气
防止D中的溶液进入B
(2) Cl—Cl2 ClO—HClO
(3) ①Cl2 + H2O HClO+HCl、CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强
②CaCO3 +2Cl2 + H2O === 2 HC1O + CO2 + CaCl2
(写成2CaCO3 +2Cl2 + 2H2O === 2 HC1O+ CO2+ CaCl2+Ca(HCO3)2给分)
(4)①其他条件相同时,氢离子浓度不同对化学反应速率的影响 ②5
(5)收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化
- 上一篇:2016浙江高考文科数学试题解析
- 下一篇:2017年高考尖子生必做化学试题及答案













